|
Klucz do oznaczania słodkowodnej makrofauny bezkręgowej |
|
|
METODYKA POBIERANIA PRÓBEK MAKROFAUNY BEZKRĘGOWEJ (cz.1 z 2)
Szczegółowa metodyka pobierania i opracowywania próbek makrofauny bezkręgowej opisana jest w różnych podręcznikach, a w odniesieniu do oceny jakości wód, w odpowiednich normach Polskiego Komitetu Normalizacji, Miar i Jakości (PN 86 C-05550/06) i w normach międzynarodowych (ISO 7828 i ISO 9391, oraz w normach CEN). W standardowych badaniach jakości wód powierzchniowych obowiązują normy zatwierdzone przez Polski Komitet Normalizacyjny. W tym rozdziale chciałbym więc jedynie zwrócić uwagę na pewne bardziej ogólne zagadnienia metodyczne.
Często mylnie jest rozumiane pojęcie próby i próbki. Próbka to pojedyncza porcja materiału (osadów dennych, roślin, kamieni, wody, lub też zasiedlających je organizmów) pobranego w środowisku. Próba natomiast to seria próbek pobranych w określonym środowisku, na określonym stanowisku i w jednym czasie; w skrajnym przypadku próbę może stanowić nawet jedna próbka, jest jednak lepiej z powodów, o których poniżej, aby na jedna próbę składała się seria próbek. Wiąże się z tym kwestia wielkości próby i próbki oraz pojęcie reprezentatywności próby. Próba powinna być reprezentatywna, a więc odzwierciedlać charakter występowania organizmów w środowisku. Tak więc wielkość pojedynczej próbki uzależniona musi być od wielkości występujących w środowisku organizmów, od ich liczebności lub wielkości ich areałów, a liczba próbek od typu przestrzennego rozmieszczenia organizmów. W praktyce oznacza to, że nie można pobierać próbek w celu zbadania występowania np. dużych małży z rodziny skójkowatych (Unionidae), których rozmiary często przekraczają 10 cm, przy użyciu chwytacza dna o średnicy otworu rury poniżej 10 cm. W rzeczywistości tzw. powierzchnia chwytna używanego aparatu musi być dużo większa od powierzchni potencjalnej "zdobyczy". Nie można jednak przesadzić w druga stronę, gdyż pobranie zbyt dużej ilości materiału może w praktyce uniemożliwić jego opracowanie, stad przy analizie występowania np. drobnych skąposzczetów (Oligochaeta), często występujących masowo, zbędne jest posługiwanie się chwytaczem dna Birge'a-Ekmana o powierzchni chwytnej 225 cm2, lub też można też ograniczyć się do opracowania jedynie podpróbki z pobranej dużej próbki, jednak istotna jest wtedy metoda pobrania tej podpróbki. Korzystne jest, aby liczba próbek pobranych jednorazowo na stanowisku była możliwie duża (10-20 to liczba optymalna; przy użyciu aparatów o dużej powierzchni chwytnej może jednak wystarczyć 3 do 5 próbek), gdyż większość organizmów rozmieszczonych jest w środowisku skupiskowo (dwa inne typy rozmieszczenia to rozmieszczenie losowe, bardzo rzadko spotykane, i rozmieszczenie równomierne, w warunkach naturalnych spotykane u organizmów o wyraźnie zaznaczonym terytorializmie). Duża liczba próbek pozwala nam uniknąć błędów spowodowanych przypadkowym "trafieniem" w skupienie lub w miejsce pomiędzy skupieniami organizmów. Pozwala nam również w przypadku badań ilościowych na określenie, poza średnia liczebnością, także któregoś ze wskaźników zmienności (najczęściej odchylenia standardowego) i sprawdzeniu istotności różnic pomiędzy średnimi z różnych prób (a więc pomiędzy liczebnościami organizmów w różnych środowiskach).
Istotne jest również miejsce wyboru stanowiska pobierania próbek, gdyż pewne organizmy są związane z określonymi siedliskami lub mikrosiedliskami, np. na próżno byśmy szukali dużych małży z rodziny skójkowatych na dnie kamienistym, a z drugiej strony małża racicznicy zmiennej (Dreissena polymorpha) na dnie piaszczystym lub mulistym. Jest to o tyle istotne, że czas pobierania materiału jest często ograniczony, a z drugiej strony różny stopień dostępności środowiska może prowadzić do pobierania próbek w miejscu najłatwiej dostępnym, ale bynajmniej nie reprezentatywnym dla całości badanego ekosystemu.
Duże znaczenie ma też czas pobierania próbek (jeśli pobieramy je jednorazowo) lub częstotliwość ich pobierania. W każdym razie należy pamiętać, że środek lata jest tu okresem najbardziej niekorzystnym ze względu na wyloty owadów, a za najbardziej reprezentatywny okres można uważać późną wiosnę.
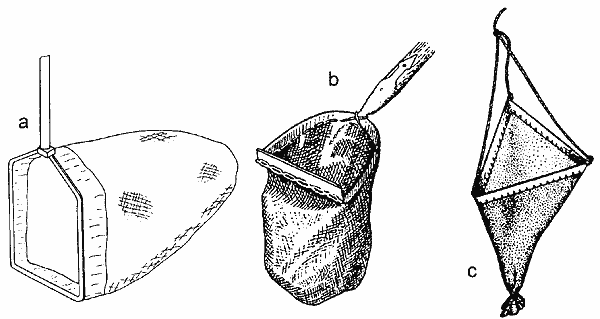
Metoda pobierania próbek uzależniona jest od celu badań. Najbardziej podstawowym celem jest uzyskanie informacji o składzie taksonomicznym (gatunkowym) organizmów zasiedlających określone środowisko. W tym celu wykorzystujemy najprostsze metody badań, zwane jakościowymi. Duże organizmy w płytkiej wodzie można zbierać pojedynczo, raczej przy pomocy małej siateczki lub pęsety (gdyż niektóre, jak np. duże chrząszcze lub pluskwiaki, mogą boleśnie ukąsić). Do wykorzystywanych urządzeń zaliczamy tu kasarek (Rys.2a) (zwany niekiedy kaszorkiem lub czerpakiem) i jego modyfikację, zapatrzoną w nóż na dolnej, prostej krawędzi - skrobak dna (Rys. 2b). Wielkość otworów siatki kasarka powinna wynosić ok. 0,4-0,5 mm. Kasarkiem pobieramy próbki wśród roślin, energicznie przeciągając nim wielokrotnie w toni wodnej, strącając i zagarniając organizmy, lub zagarniając porcję roślin zanurzonych. Skrobak dna umożliwia, dodatkowo, pobranie porcji osadów dennych. W głębszej wodzie wykorzystujemy ciągnioną po dnie, za łódką lub z brzegu, sieć, tzw. dragę denną (Rys. 2c), obszytą wokół ciężkiej, metalowej, zwykle trójkątnej ramy. Zebrane w ten sposób materiały pozwalają na określenie składu gatunkowego, a jeśli wyizolowane są wszystkie organizmy z pobranej próbki także na określenie zróżnicowania gatunkowego (najczęściej wyrażonego przez wskaźnik Shannona) lub struktury dominacji (procentowego udziału poszczególnych gatunków, lub taksonów wyższej rangi w łącznej liczbie zebranych organizmów).
Rys. 2. Przyrządy po pobierania jakościowych próbek makrofauny bezkręgowej: a. kasarek; b. skrobak dna; c. draga denna trójkątna
Wykorzystując wymienione wyżej urządzenia można również pobierać tzw. próbki półilościowe, pozwalające uzyskać (niezbyt precyzyjne) dane o ilościowym występowaniu danych organizmów, lub dane porównawcze. Można np. w różnych środowiskach pobierając próbki kasarkiem, wykonać taką samą liczbę "pociągnięć" w wodzie na takim samym odcinku (np. 10 "pociągnięć na odcinku 1 m każde). Uzyskane wartości nie mówią nic o rzeczywistej liczebności (zagęszczeniu), ale pozwalają ocenić różnice liczebności pomiędzy poszczególnymi środowiskami. Dane o liczebności makrofauny dennej (mało precyzyjne) można uzyskać mnożąc szerokość otworu (długość ostrza) skrobaka dna lub krawędzi ramy dragi dennej przez długość drogi, na której prowadzono po dnie te urządzenia - uzyskamy w ten sposób wielkość powierzchni, z której zebrano określoną ilość organizmów.
Ważnym wskaźnikiem występowania danej grupy organizmów może być też frekwencja, czyli procent próbek, w których występują (choćby 1 osobnik) przedstawiciele tych organizmów; warunkiem jest, aby liczba zebranych ogółem próbek nie była mniejsza niż 10.
|
|